Appena smontate tutte le luminarie delle festività natalizie nel riporle a posto scorrono fra le nostre mani decine di LED, le piccole lucine colorate collegate lungo i fili. Non sono passati poi moltissimi anni da quando queste lucine erano normali lampadine ad incandescenza, quelle classiche per intenderci. Sono state soppiantate quasi completamente per una ragione principale: analoghe soluzioni a LED consumano meno energia elettrica per produrre la stessa intensità luminosa. In altre parole, il maggior costo iniziale delle nuove sorgenti luminose è presto compensato dal drastico risparmio sui consumi elettrici e quindi sulla relativa bolletta.
Volendo tagliare corto potrei citare la Pillola di Scienza numero 18 riguardante i pannelli solari [1] e dire semplicemente che i LED sono il loro opposto, ma una descrizione dedicata è certamente migliore.
Come nel caso dei pannelli solari, anche i LED sono costruiti utilizzando materiali semiconduttori e in particolare il Silicio, costituente i primi prototipi, nati sull’esperienza dei transistor a stato solido.
Ricordiamo che un materiale semiconduttore è per così dire a metà strada fra un perfetto isolante (ad esempio la ceramica) ed un ottimo conduttore (ad esempio il rame). Riprendendo in parte quanto già discusso nell’articolo citato [1], il passaggio di corrente elettrica in un materiale è dettato da quanto distanti sono le bande energetiche delle sue cariche elettriche: in un isolante sono talmente distanti che prima di riuscire a far passare un elettrone nella banda superiore si assiste tragicamente alla distruzione del materiale stesso; in un conduttore invece le bande energetiche sono così vicine (talora sovrapposte) che basta fornire una bassa energia affinché gli elettroni si trasferiscano in massa nella banda superiore. Passando da un materiale isolante a uno conduttore si ha dunque una sorta di effetto “tutto o niente”, o non scorre corrente elettrica oppure ne scorre tantissima.
I semiconduttori si trovano nel mezzo: la banda inferiore, così detta “di valenza” e quella superiore chiamata “di conduzione” sono più vicine che in un materiale isolante, ma più distanti che in un conduttore:
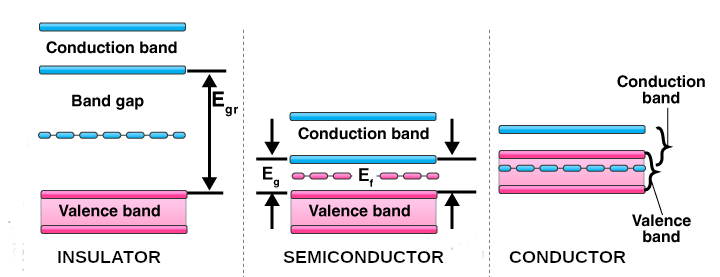
Figura 1. Le bande energetiche formano un “gap” enorme negli isolanti e inesistente nei conduttori, mentre è una via di mezzo per i semiconduttori.
Nei semiconduttori ciò permette di agire sulla corrente in un modo nuovo, impossibile da ottenere con le altre due tipologie di materiali: si può “modulare” la corrente elettrica, ovvero si può decidere quanta farne scorrere in ciascun istante [2].
Se da un lato questa caratteristica ha permesso di realizzare i transistor e poi i circuiti integrati, dall’altro ha spalancato le porte a tutta una serie di applicazioni che riguardano la luce, tra cui la progettazione e la realizzazione di dispositivi in grado di emetterla: i LED.
L’acronimo sta per Light Emitting Diode, cioè “diodo emettitore di luce”. Si tratta quindi di un diodo con aggiunta la caratteristica di emettere radiazione luminosa. E come per un normale diodo, due sono i tipi di semiconduttore che lo compongono: uno, detto di tipo N, con un eccesso di elettroni liberi e l’altro, detto di tipo P, con un gran numero invece di posti liberi per essere occupati da elettroni. Le due lettere ricordano quindi il segno della carica netta di ciascuna delle due metà, N = negativa e P = positiva.
Il processo di fabbricazione di queste due parti, cariche in modo opposto, crea anche una sottile zona di separazione fra esse priva di qualunque carica statica, una sorta di zona di confine o terra di nessuno chiamata “Depletion region” perché appunto “svuotata” di ogni tipo di carica come visibile in Figura 2:
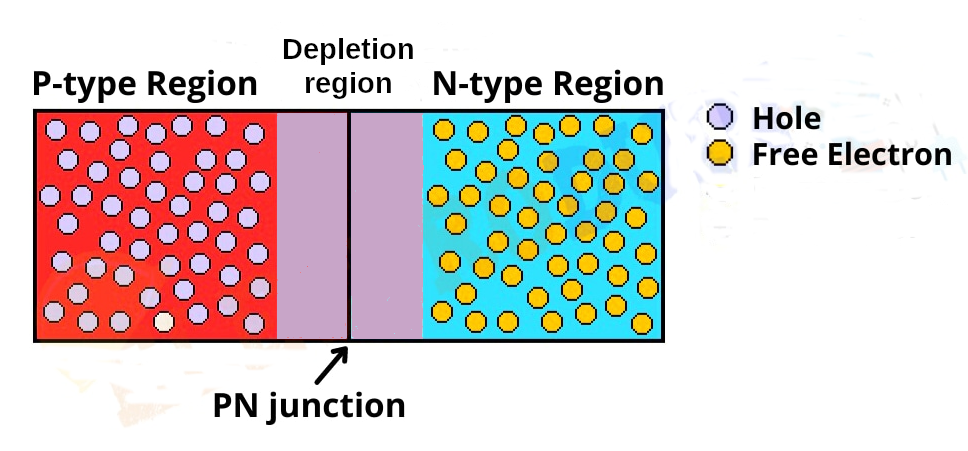
Figura 2. La giunzione PN che forma la base realizzativa dei LED. A sinistra la zona P ricca di cariche positive (lacune o ‘hole’), a destra la zona N ricca di cariche negative (elettroni), al centro la Depletion region priva di cariche.
La presenza di questa zona senza carica elettrica costituisce una barriera, un muro che non permette il travaso immediato delle cariche libere in ciascuno dei due settori ad essa confinanti, bensì le trattiene all’interno di essi.
Ma quando il LED viene connesso ad una sorgente di energia elettrica in modo conforme a queste due polarità (ad esempio ad una batteria), si induce il travaso di cariche tra le due zone adiacenti poiché esse acquistano un’energia sufficiente per superare “il muro” della Depletion region: gli elettroni liberi passano nel settore P e le cariche positive di quest’ultimo settore passano invece in quello N.
Ovviamente i due settori non devono essere mentalmente raffigurati come due recipienti, due secchi pieni rispettivamente di palline rosse e nere che una volta travasati l’uno nell’altro pongono fine al processo, ma piuttosto come due fontane da cui sgorgano continuamente nuove cariche. L’effetto “fontana” è garantito dalla batteria esterna, il vero fornitore di nuove palline. Sta di fatto che il settore P sarà costantemente ricco di un eccesso di cariche positive e quello N di cariche negative, entrambe pronte a spostarsi nell’altro settore:
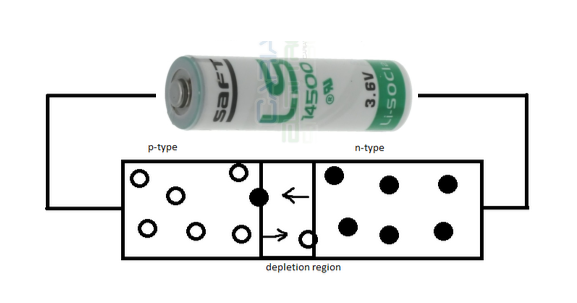
Figura 3. Se il LED è polarizzato le cariche negative (pallini neri) si spostano nella regione P, quelle positive (pallini bianchi) nella regione N, attraversando la Depletion region (vedi nota al termine).
Per questa immagine un po’ naiv e surreale del LED molti puristi mi bastonerebbero, ma io ritengo che sia una buona rappresentazione di ciò che succede in realtà, descritto in modo semplice. Ma che fine ha fatto la luce in tutto questo discorso ?
Durante il transito, le particelle cariche positivamente e quelle cariche negativamente hanno un’elevata probabilità di incontrarsi, annichilendosi (neutralizzandosi) e liberando energia sotto forma di radiazione luminosa. Questo fenomeno può essere meglio descritto e compreso in termini di energia, ricordando le bande di valenza e di conduzione introdotte più sopra: le lacune (carica +) si trovano nella banda di valenza, a energia più bassa di quella di conduzione, in cui invece si trovano gli elettroni (carica -). Quando un elettrone incontra una lacuna, salta giù nella banda di valenza e rilascia il proprio eccesso di energia sotto forma di un fotone luminoso [3], ovvero un “quanto di luce” come rappresentato in Figura 4:
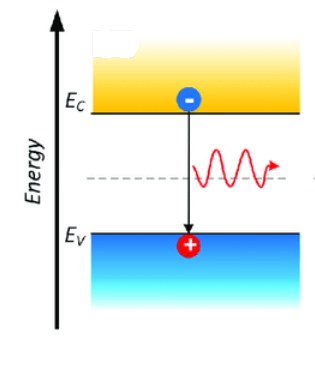
Figura 4. Se un elettrone (pallina azzurra, carica negativa) passa al livello energetico più basso annichilendosi con una lacuna (pallina rossa, carica positiva), l’energia viene rilasciata sotto forma di un fotone luminoso.
Dato l’elevato numero di cariche in circolo, l’effetto macroscopico è l’emissione di una intensa radiazione luminosa, per poter fruire della quale il semiconduttore è immerso in una resina trasparente come visibile in Figura 5. Talora la resina è a sua volta colorata, per filtrare ancor meglio la luce emessa e ridurla ad un colore ben preciso:
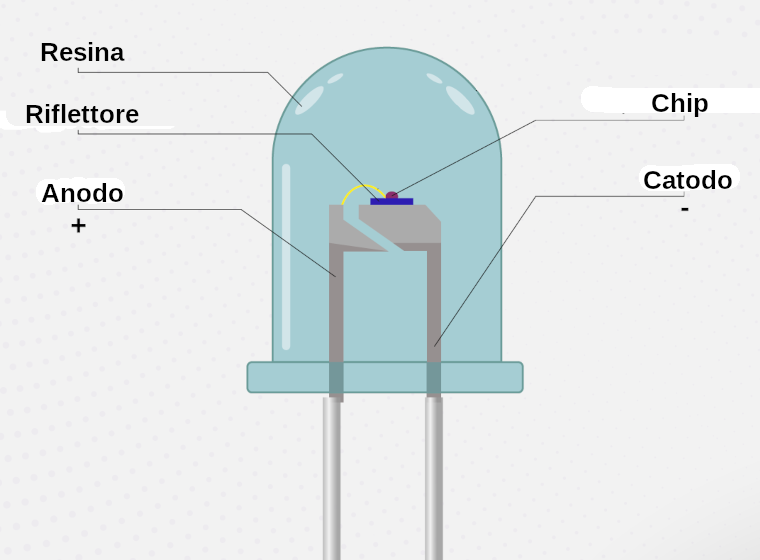
Figura 5. Struttura di un LED con evidenziati i due terminali di catodo e anodo.
Il colore della luce emessa dipende da quanto grande è il salto energetico degli elettroni verso la banda di valenza, o in altre parole da quanto distanti sono le due bande nella particolare struttura PN presa in considerazione. E questa distanza è legata unicamente al tipo di materiale utilizzato. Quindi per realizzare LED di vario colore è stato necessario progettare e selezionare molteplici tipologie di materiali semiconduttori, ottenuti accoppiando singoli elementi della tavola periodica. Ad esempio, partendo da una base costituita da Gallio (Ga) e Arsenico (As), che emette luce infrarossa e quindi non-visibile dagli umani, l’aggiunta di altri elementi fa variare il salto energetico fra banda di valenza e di conduzione permettendo l’emissione di luce visibile. Così con l’aggiunta di Alluminio (Al) si ottiene il semiconduttore “AlGaAs” che emette luce rossa, mentre utilizzando il Fosforo (P) si ricava “GaAsP” che sposta ulteriormente la lunghezza d’onda nell’arancione. Altri semiconduttori coprono l’intero spettro luminoso e oggi abbiamo a disposizione LED in grado di emettere dall’infrarosso all’ultravioletto.
Commercialmente i LED sono stati ottimizzati per soddisfare tutte le esigenze. Esistono modelli per tutti i gusti, da quelli a bassa potenza intesi per utilizzo come indicatori luminosi, ad esempio il famoso “pallino rosso” della televisione in stand-by, fino a quelli ad altissima potenza per l’illuminazione stradale. Esistono LED di varie forme e dimensioni, ottimizzati anche nell’angolo di emissione della luce, dai più stretti 10 gradi fino a quasi 180 gradi, utilizzabili rispettivamente dove serve un fascio luminoso quasi puntiforme e dove invece è necessaria la più ampia diffusione laterale (alcuni modelli di indicatori a bassa potenza sono visibili in Figura 6):

Figura 6. LED di varia fattura e dimensione. Il penultimo a destra ha 3 terminali perché contiene in realtà due LED nel medesimo involucro, i quali hanno il catodo condiviso.
L’accostamento in spazi molto piccoli di LED rossi, verdi e blu ha permesso di realizzare unità RGB (appunto Red-Green-Blue) in grado di “simulare” per l’occhio umano qualunque colore della scala cromatica. Questa tecnologia è stata implementata con successo nei grandi display di monitor e televisori.
I LED oggi tendono a sostituire quasi in ogni applicazione le venerabili lampadine, di cui parlerò in separata pillola. La ragione principale è l’alta efficienza che li contraddistingue, ovvero a parità di energia elettrica fornita (da una batteria o dalla rete elettrica) emettono maggiore intensità luminosa della gloriosa controparte a incandescenza.
Marco Sartore
Riferimenti bibliografici e note
Nota: la Figura 3 mostra una connessione puramente teorica fra LED e batteria utile per comprendere il testo ma non per realizzare un prototipo. Infatti, se la corrente elettrica non viene in qualche modo limitata, il suo passaggio incontrollato porta al surriscaldamento del semiconduttore e ad una rapida distruzione del LED. Quindi il lettore eventualmente interessato a sperimentare si guardi bene dal connettere direttamente una batteria ad un LED come la Figura 3 mostra (mi può contattare per capire come limitare la corrente).
2. “The Art of Electronics”, W. Hill and P. Horowitz, Cambridge University Press, ISBN 978-0-521-37095-0
3. https://www.elbareport.it/scienza-ambiente/item/69976-pillole-di-scienza-16-quanti,-ce-ne-sono
































